产品货号:
YTB4180
中文名称:
T7 RNA聚合酶
英文名称:
T7 RNA Polymerase,1000U/μL
产品规格:
25kU|100kU|500kU
发货周期:
1~3天
产品价格:
询价
T7 RNA聚合酶是一种高度特异识别T7启动子序列的DNA依赖的5'→3' RNA聚合酶。T7 RNA Polymerase可以催化单链或双链DNA T7启动子下游NTP的掺入,合成与T7启动子下游的模板DNA互补的RNA。
T7 RNA聚合酶不仅可以进行常规的RNA合成,还可以识别修饰的NTP,例如生物素标记、地高辛标记、荧光素标记的NTP,可以用于各种标记RNA的合成。同时对于T7启动子有高度的特异性。

用于RNA合成,合成的RNA可以用于或用作:杂交探针,基因组DNA序列分析,核糖核酸酶保护测定,反义RNA合成,作为体外翻译的RNA模板,RNA剪接研究的底物,RNA二级结构和RNA-蛋白质相互作用,核酸扩增分析,siRNA、miRNA等小RNA。

由大肠杆菌表达,表达基因为嗜菌体T7 RNA Polymerase基因。

1个活性单位是指37℃条件下,60分钟内,催化1nmol AMP掺入到多聚核苷酸中所需的酶量。
活性检测条件:40mM Tris-HCl (pH8.0),6mM MgCl2,10mM DTT,2mM spermidine,0.5mM NTP,0.6MBq/ml [3H]-ATP,20μg/mL plasmid DNA containing the specific T7 RNA Polymerase promoter sequence。

| 组分 | 25kU | 100kU | 500kU |
| T7 RNA聚合酶(1kU/μL) | 25μL | 100μL | 500μL |
| 10×T7 Transcription Buffer | 600μL | 1.2mL×2 | 12mL |
保存:-20℃

50mM Tris-HCl(pH7.5@25℃),100mM NaCl,1mM DTT,1mM EDTA,50% (v/v) Glycerol,0.1% (w/v) Triton X-100。

10×T7 Transcription Buffer:
400mM Tris-HCl(pH7.9@25℃),20mM spermidine,60mM MgCl2,10mM DTT。

不含DNA内切酶和外切酶,不含RNA酶。

- 70℃加热10分钟可使T7 RNA Polymerase失活。
- 加入适量EDTA也可以使T7 RNA Polymerase失活。
- 螯合剂、浓度大于150mM的钠、钾或铵盐可以显著抑制T7 RNA Polymerase的活性。

T7 consensus promoter sequence如下,其中的G为转录的第一个碱基。
TAATACGACTCACTATAGGGAGA

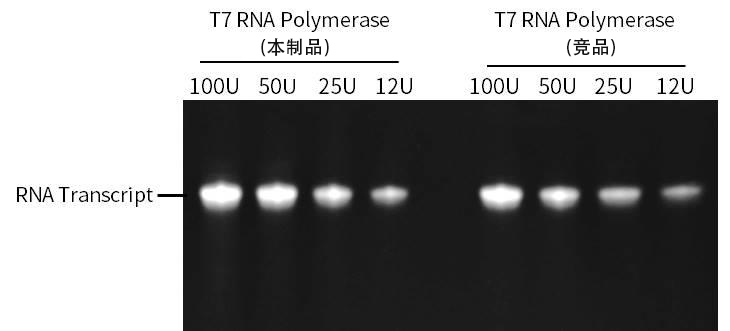
图1.本制品与N公司T7 RNA Polymerase以含有T7 Promoter的PCR产物为模板进行体外转录时的效果图。在20μL反应体系(40mM Tris-HCl pH7.9,2mM Spermidine,6mM MgCl2,1mM DTT)中,加入以含有T7 Promoter的PCR产物作为模板DNA以及图中指定量的本制品或N公司的T7 RNA Polymerase,37℃孵育1h,70℃孵育10min终止反应,加入2U DNase I溶液消化模板DNA,得到的RNA转录产物为101nt。取出5μL反应产物,加入1μL 6×DNA上样缓冲液,95℃变性5min,然后室温条件下用含7M Urea的15%聚丙烯酰胺凝胶进行电泳,以1×TBE作为电泳液,180V电泳120min。电泳结束后,NadRed红色核酸染料2000倍稀释后室温染色10min,拍照观察结果。如图所示,本制品与N公司的竞品相比,具有相近或略优的转录效果。

- RNA合成:
- DNA模板经限制性核酸内切酶酶切线性化。
- 酚/氯仿抽提DNA,用乙醇沉淀后,溶于适量的无菌去离子水中。本步骤也可以使用适当的DNA纯化试剂盒,例如产物DNA纯化试剂盒,直接进行纯化,从而免去了酚氯仿抽提和乙醇沉淀这些步骤。
- 参考如下表格设置反应体系。如有必要,可以把T7 RNA聚合酶(1kU/μL)适当稀释后使用。
成分 用量 10×T7 Transcription Buffer 2μL NTP Mixture(10mM each) 4μL 线性DNA模板 0.4~1μg RNase抑制剂(40U/μL) 0.5μL T7 RNA聚合酶(1kU/μL) 0.04~0.1μL 经DEPC处理的去离子水 至20μL - 按上表设置好反应体系后,轻轻混匀(可以用移液器吹打混匀或用Vortex在最低速度轻轻混匀),随后离心沉淀液体。
- 37℃孵育1~2个小时。
- 加入2μL 0.5M EDTA (pH8.0)到反应体系中混匀或-20℃冷却终止反应。
- 电泳分析转录产物,或通过其他适当方法鉴定转录的效率。
- 转录需在无RNA酶条件下进行。
- 反应体系需在室温条件下配置,4℃有亚精胺(spermidine)存在时DNA可发生沉淀。
- 按以上反应条件,每1μg模板DNA可合成超过10μg的RNA。
- 如果模板DNA的线形化不太完全,会导致转录出比预期长度更长的RNA,同时使预期长度的转录本比例下降。
- 可根据实际情况按照比例放大或缩小上述反应体系。
- DNA模板经限制性核酸内切酶酶切线性化。
- 放射标记RNA的合成:
- DNA模板经限制性核酸内切酶酶切线性化。
- 酚/氯仿抽提DNA,用乙醇沉淀后,溶于适量的无菌去离子水中。本步骤也可以使用适当的DNA纯化试剂盒,例如产物DNA纯化试剂盒,直接进行纯化,从而免去了酚氯仿抽提和乙醇沉淀这些步骤。
- 参考如下表格设置反应体系。如有必要,可以把T7 RNA聚合酶(1kU/μL)适当稀释后使用。
成分 用量 10×T7 Transcription Buffer 2μL 3 NTP Mixture (10mM each,without CTP) 1μL 100μM CTP 2.4μL [α-32P]-CTP,~30TBq/mmol(800Ci/mmol) 1.85MBq(50μCi) 线性DNA模板 0.2~1μg RNase抑制剂(40U/μL) 0.5μL T7 RNA聚合酶(1kU/μL) 0.05μL 经DEPC处理的去离子水 至20μL - 37℃孵育1~2个小时。
- -20℃冷却终止反应。
- 分析和检测RNA的标记效率。
- 按以上方法合成的RNA活性一般为3-5 x108 dpm/μg。
- 上述标记反应中也可以使用[32P]、[35S]或[3H]标记的其他NTP。使用其他放射性标记的NTP时,其他的NTP需作相应调整。20μL反应体系各成分推荐使用剂量分别为:
1.85MBq (50μCi) 5'-[α-32P]-CTP ~30TBq/mmol(800Ci/mmol) 11.1MBq (300μCi) 5'-[α-35S]-UTP >37TBq/mmol (>1000Ci/mmol) 0.925MBq (25μCi) 5,6-[3H]-UTP 1.1-2.2TBq/mmol (30-60Ci/mmol) - 放射性标记NTP浓度低于12μM时,全长转录本合成效率也会下降。
- DNA模板经限制性核酸内切酶酶切线性化。
- 生物素标记、地高辛标记等其它用途可以参考上述用途或相关文献资料进行。
相关搜索:T7 RNA聚合酶,RNA聚合酶,T7 RNA Polymerase,1000U/μL



